Трехмерная (3D) печать пробивает дорогу ключевым инновациям во многих сферах, таких как инженерное дело, промышленность, искусство, образование и медицина. Последние достижения науки позволили осуществлять 3D-печать биосовместимых материалов, клеток и их вспомогательных компонентов с дальнейшим созданием на их основе полнофункциональных живых тканей. 3D-биопечать можно использовать в регенеративной медицине для трансплантации необходимых тканей и органов. По сравнению с 3D-печатью из неорганических материалов, в биопечати существуют усложняющие процесс факторы, такие как выбор материалов, типов клеток, факторы их роста и дифференцировки, а также технические сложности, связанные с сенситивностью клеток и формированием тканей. Для решения этих проблем необходимо взаимодействие технологий из сферы инженерии, науки о биоматериалах, клеточной биологии, физики и медицины. Метод 3D-биопечати уже используется для выращивания и трансплантации некоторых тканей, в числе которых многослойный эпителий, кость, сосудистые трансплантаты, трахеальные шины, ткани сердца и хрящевые структуры. Другие области применения трехмерной биопечати включают моделирование тканей с высокими фармакодинамическими показателями в исследовательских целях, а также для разработки новых лекарств и токсикологического анализа.
Изобретение ксилографии с последующим внедрением печатного пресса в производственный процесс в промышленности XV века позволило быстрее воспроизводить текстовые и графические данные, а также ускорило распространение информации. Печать совершила революцию в обществе, оказав влияние на политику, религию, образование и язык во всем мире. В последние десятилетия технологии печати шагнули далеко вперед — от двухмерной печати до аддитивного процесса, в котором последовательным наложением слоев формируются трехмерные объекты. Создание 3D объектов сложной геометрической формы применяется как для быстрого создания макетов и производства продукции, так и для производства потребительских товаров, таких как велосипедные детали, украшения или электрические компоненты — буквально в домашних условиях. Помимо использования в производстве и потребительском секторе, 3D печать дает новые возможности для науки и образования. Например, археологи и антропологи могут создать копии редких артефактов или ископаемых, которые можно брать в руки, свободно делиться ими и распространять. Подобно тому, как Уотсон и Крик смоделировали структуру ДНК из шариков и палочек, в наши дни 3D-печать используется для моделирования сложных молекул, создания моделей взаимодействия белковых соединений, а также для изготовления лабораторных инструментов под заказ.
3D-печать дает студентам доступную возможность проектировать, визуализировать, облекать в физическую форму свои идеи и тестировать их в реальных условиях. Метод 3D-печати был впервые описан в 1986 году Чарльзом В. Халлом. По его методу, названному «стереолитографией», тонкие слои материала, затвердевая под действием ультрафиолетовых лучей, последовательно формируют слои твердой трехмерной структуры. Позднее этот метод стал использоваться для создания композитных форм для культивирования клеток на трехмерных подложках-носителях, так называемых «скаффлодов», из биологических материалов. Развитие систем на водной основе, не содержащих растворителей, сделало возможным напрямую печатать скаффолды из биоматериалов для использовании их в трансплантации, с подобранными клетками или без них. Следующей ступенью была 3D биопечать как метод инженерии тканей, что стало возможным благодаря последним достижениям в технологиях трехмерной печати, клеточной биологии и материаловедения. Другой родственной сферой применения 3D печати стало производство медицинских приборов, таких как стенты и шины для клинического использования. В 3D-биопечати для формирования трехмерных структур применяется аддитивное наращивание биологических материалов, биохимикатов и живых клеток послойно с контролем размещения функциональных компонентов в пространстве. Существует несколько подходов к 3D биопечати, в том числе биомимикрия, автономная самосборка и наращивание из тканевых «кирпичиков»
Исследователи развивают эти подходы с целью создать трехмерные функционирущие в человеческом организме конструкции, которые будут обладать биологическими и механическими свойствами, необходимыми для заживления ткани и функционирования органа. Одной из наиболее важных проблем является необходимость приспособления технологий, созданных для печати расплавленного пластика и метала, к печати чувствительных, живых биологических материалов. В то же время необходима работа над решением вопроса о репродукции сложной микроархитектуры компонентов ВКМ (внеклеточного матрикса) и многочисленных типов клеток в достаточном количестве для выполнения биологических функций.
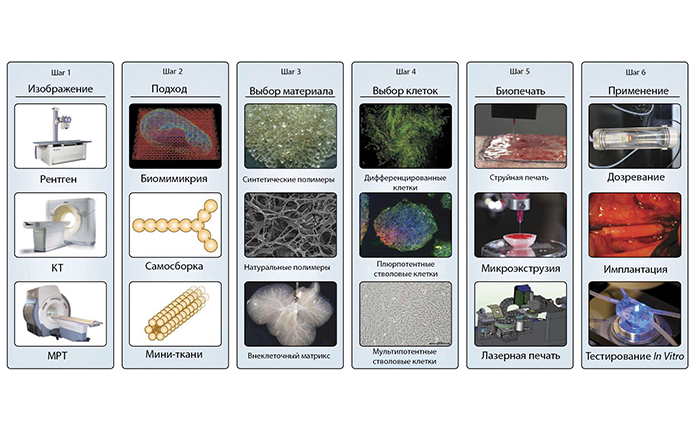
В этой статье мы рассмотрим применение 3D-печати в тканевой и органной инженерии. Первым шагом раскрытия данного вопроса будет рассмотрение основных стратегий печати тканевых конструкций. Далее мы опишем различные типы биопринтеров и их влияние на готовые печатные тканевые конструкции. И, наконец, обсудим пошаговый процесс печати ткани, технологические ограничения на данном этапе развития науки и проблемы, которые необходимо решить в ходе будущих исследований. Трехмерная биопечать основывается на трех основных подходах: биомимикрии, автономной самосборке и построении тканевых мини-блоков. Рассмотрим каждую из этих стратегий более детально (Рис.1).
БИОМИМИКРИЯ
Инженеры уже давно обращаются к природе в ходе решения серьезных технических проблем, как, например, при конструировании воздушного транспорта, выборе материалов, клеточном культивировании и нанотехнологии. Такой подход к 3D-биопечати подразумевает изготовление идентичных копий клеточных и внеклеточных компонентов ткани или органа. Этого можно достичь путем создания определённых клеточных компонентов ткани или биоматериалов, физиологически соответствующих данной ткани. Для того, чтобы достичь результатов при использовании данного метода, необходима репликация биологических тканей уже на микроскопическом уровне. По этой причине важно точное понимание строения и функционирования микросреды (включая специфическое микроокружение основных и поддеживающих клеток), градиентов растворимых и нерастворимых факторов, строения внеклеточного матрикса, природы биологических явлений, которые возникают внутри клетки. Получение новых данных в этой сфере обусловливает необходимость различных исследований в области инженерии, биоматериалов, клеточной биологии, биофизики и медицины, что нужно для получения продуктивных результатов при использовании данного подхода. АВТОНОМНАЯ САМОСБОРКА
Еще одним подходом к воспроизведению биологических тканей является использование стратегии развития органов в эмбриогенезе как базовой основы. Так, ранние клеточные компоненты развивающейся ткани производят свои собственные элементы внеклеточного матрикса, приобретают сигнальные системы, организацию и характеристики, обусловливающие желаемую микроархитектуру и функции. «Бескаркасный» вариант этого подхода включает использование самособирающихся клеточных сфероидов, которые будут подвергаться расплавлению и клеточной реорганизации для воссоздания развивающихся тканей. Принцип автономной самосборки основывается на том утверждении, что клетка как основной стимулирующий фактор гистогенеза управляет структурной организацией, локализацией и основными свойствами ткани. Применение этого подхода требует глубоких знаний механизмов развития тканей в эмбриогенезе, а также разработки методов управления микроокружением ткани для регулирования механизмов клеточной дифференцировки в готовой печатной модели.
МИНИ-ТКАНИ
Концепция мини-тканей уместна для обеих вышеупомянутых стратегих трехмерной биопечати. Органы и ткани будут состоять из небольших функционирующих блоков, так называемых «мини-тканей» — наименьших структурных и функциональных компонентов ткани. Мини-ткани могут быть объединены в конструкции большего размера как оптимальным предварительным размещением, так и без стороннего вмешательства. Не исключается и комбинация этих методов. Таким образом, существуют две основные стратегии. Первая – самособирающиеся клеточные сфероиды, которые будут объединены в ткани с помощью физиологичного размещения. Вторая – полученные тканевые единицы будут сами собираться в функционирующую ткань без каких-либо вмешательств извне. Практическим примером применения данных методов может быть самосборка сосудистых блоков при формировании ветвящегося васкулярного дерева, и биопечать функциональных тканевых блоков, которые образуют «кристальный орган», укрепляющийся микрожидкостными сетями и используемый для изучения влияния наркотиков и вакцин или как модель для изучения болезней in vitro.
Скорее всего, для печати мультифункциональной комплексной трехмерной структуры будет необходимо комбинировать вышеупомянутые стратегии. Главные этапы печати, общие для всех методов, таковы: создание образа и оформление, проектирование, выбор материалов и клеток, печать тканевой конструкции (Рис.1). Далее печатная конструкция трансплантируется (иногда после созревания in vitro) или подвергается анализу в лабораторных условиях.
Визуализация и цифровой дизайн
Необходимым требованием к репродукции гетерогенной структуры функциональной ткани или органа является исчерпывающее понимание структуры и организации их компонентов. Медицинские технологии визуализации — это незаменимый инструмент тканевых инженеров, используемый для обеспечения сохранения информации трехмерной структуры и функционирования клеточного, тканевого, органного и организменного уровней жизни. Эти технологии включают в себя большинство неинвазивных методов визуализации, самыми распространенными из которых являются КТ (компьютерная томография) и МРТ (магнитно-резонансная томография). Инструменты компьютерного моделирования и автоматического производства (CAD-CAM), а также математическое моделирование используют, чтобы собирать и оцифровывать комплекс томографической и структурной информации о ткани.
Моделирование с помощью компьютерной томографии используют как для диагностики, так и для интервенционных процедур, которые базируются на разнице в поглощении рентгеновских лучей теми или иными тканями. Источник излучения вращают вокруг объекта, и пучок рентген лучей проходит сквозь тело, а тем временем сенсоры измеряют интенсивность выпущенного пучка и угол его отклонения и записывают информацию о комбинации пикселей, которые представляют небольшую часть (воксел — элемент объёмного изображения) ткани. Данное модальное изображение воспроизводит плотно расположенные слои (срезы) ткани, так что после рендеринга поверхности и стереолитографического редактирования мы имеем полное объемное изображение ткани.
Второй метод – МРТ, также может обеспечивать высокое пространственное разрешение в мягких тканях, с преимущественно повышенным контрастным разрешением, что является безусловно полезным для моделирования мягких тканей в непосредственной близости к другим типам тканей без использования ионизирующей радиации. МРТ использует ядерно-магнитный резонанс: сильное магнитное поле заставляет небольшую часть ядер в ткани выстраиваться в линию относительно магнитного поля. Изменения в энергетических состояниях нуклеозидов создает радиочастотные сигналы, которые измеряются приемными катушками. Контраст в биоструктурах может быть значительно повышен при помощи таких контраст-агентов, как барий или йод для КТ, гадолиний или металопротеины для МРТ. Это вещества ослабляют рентген лучи или усиливают магнитно-резонансные сигналы, которые обычно используют для выделения структур, таких как круги кровообращения, которые в противном случае довольно сложно выделить из их окружения.
После того как изображение было получено, данные должны быть обработаны с использованием томографической реконструкции для получения 2D изображения поперечного среза ткани. Анатомические 3D модели могут быть получены и использованы для дальнейшего анализа или модификации. Этот процесс можно назвать преобразованием «аналитической анатомии» в «синтетическую анатомию». Один из способов создания компьютерных 3D-модели структуры органов или тканей подразумевает использование инструментов компьютерного моделирования и автоматического производства, а также математического моделирования. Трёхмерные анатомические изображения дают наглядное представление об облике органа в нескольких проекциях, сохраняя воксельную информацию, которую можно применить для формирования объёмного изображения. Восстановленные изображения или модели можно рассматривать несколькими способами, в том числе в виде контурных стеков, в качестве каркасных моделей, затененных моделей или твердотельных моделей с различным освещением, прозрачностью и отражательной способностью. Если целью является точное отображение органа или ткани, то двухмерное сечение или 3D-модель могут быть использованы непосредственно для биопечати. Кроме того, точная копия собственного органа пациента может быть нежелательной вследствие болезни или ранения или экономически нецелесообразной для крупномасштабного производства. В этой ситуации компьютерные модели могут полностью или частично способствовать анатомическому структурному проектированию, анализу и моделированию. Кроме того, компьютерное моделирование может помочь в прогнозировании механических и биохимических свойств готовых биоконструкций.
Законченная виртуальная модель органа или ткани обрабатывается цифровыми автоматическими системами печати для прототипирования и серийного выпуска. Это достигается преобразованием двухмерной вёрстки в трёхмерную таким образом, что трёхмерная модель делится на тонкие двухмерные слои (чьи толщина и положение в пространстве настраиваемы), которые импортируются в буферное запоминающее устройство биопринтера. Анатомическая и струкктурная информация, содержащаяся в двухмерных моделях слоёв, снабжает биопринтер инструкциями по послойному расположению биоматериала. Различные технологии трёхмерной печати по-разному подходят к формированию тканей и органов. В одних случаях системы трёхмерной печати располагают на основу по маленькой порции материала, чтобы крупицей за крупицей собрать в объёме требуемый орган или ткань. Другие трёхмерные принтеры укладывают относительно большие объёмы материала сразу на протяжении определённого периода. При поиске подхода к формированию ткани необходимо учитывать возможности и особенности биопринтеров, о чём будет рассказано ниже. Главные технологии, которые используются для расположения и размещения биологического материала – это струйная, микроэкструзионная и лазерная печать. Различные свойства, характерные для этих технологий, должны быть учтены в соответствии с важнейшими факторами трёхмерной биопечати – поверхностное разрешение, выживаемость клеток в составе материалов и собственно биологические материалы, задействованные в печати.
Полный текст статьи на сайте:







